长春长生疫苗造假事件曾轰动一时,令人触目惊心!
事件的结局大家也都知道了:
最终,长春长生被国家国家药监局处以多项行政处罚,不单撤销了该企业的狂犬病疫苗的药品批准证明文件,还没收违法所得并加倍罚款,罚款总额更是高达到91亿元。其中涉嫌生产、销售劣药罪的18名高管也被公安机关逮捕。
对于这样的结果,足矣用大快人心来形容。本以为,事件的结局就这样完美落幕。但是,近日据多家媒体的报道,似乎自长春长生倒下后,新的麻烦也开始诞生了——疫苗不够用了。
腾讯网、财经杂志等多家媒体进行了新闻报道
01
一般来说,春冬季都是疫苗接种的高峰季,在过往这个时候,虽也曾偶尔爆出过“疫苗”短缺的问题,但往往都只是局部的出现在某个区域,问题并不明显。
不过,近日,全国各地开始陆续曝出了疫苗短缺的问题,相比之前显得更加严峻。根据财经杂志报道:
1、北京北下关社区卫生服务中心预警称,今年针对本市60岁以上老人及在校中小学生免费疫苗供应不足,不预约,打完为止。
2、兰州市城关区多家疫苗接种点流感疫苗全部断货;
3、江苏省泰州市目前只有姜堰和泰兴有少量疫苗,都被预约了;
4、广州市棠下街道向预约了11月接种流感疫苗的家长告知,目前尚未收到疫苗,请大家留意通知。
很显然,上述所例举的城市只不过是冰山一角。
在国内,制药公司的疫苗上市前通常都要经过批签发。也就是说,通过批签发可以对业内疫苗数进行一个大致预估。
目前在国内生产疫苗的大户就那么几家(主要是华兰生物、巴斯德、长春生物、长春长生、北京科兴等企业),而国内每年对疫苗的需求者数量基本是不变的。
根据2018年数据,长春长生的流感疫苗签发数在全国排在第2、仅次于华兰生物,所以当长春长生被“问斩”以后,自然总体的生产量也就下去了。
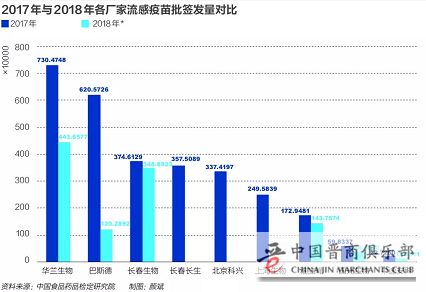
根据中国食品药品检定研究院的数据显示,截至10月28日,全国流感病毒裂解疫苗批签发总量约为1108万剂,这一数值,仅为去年同期(截至2017年10月底)流感疫苗批签发总量2926万剂的四成不到,供需缺口十分明显。
正是由于疫苗主力生产企业的退出,导致现在一个赤裸裸的问题摆在了大家面前——疫苗不够用了。
02
疫苗安全出了问题后,国家层面快速反应,对问题企业予以承重打击,这是值得称赞的。
我的观点也是这样:整顿规范是必须的,宁可不打疫苗也不能用假冒伪劣疫苗,也不能因为需求问题,让那些问题企业死灰复燃。
一般情况下,在国内,绝大多数疫苗的管理流程,都是在疫苗生产出来后,企业先对成品进行抽样检查,测出疫苗的性能、和安全没有问题之后,再送到中国药品生物制品检定所检测,等企业拿到了批签发合格证后再投入生产。
对于绝大多数疫苗,为了保证疫苗的品质和安全,大多数城市,都是由当地的疾控中心根据相关条例进行统一调配。
我国疫苗流通规定:疫苗必须采用冷链运输。冷藏车的采购一般可分为两种情况,一种是政府行为,医疗卫生机构自采自用;相关政策规定,医疗卫生机构必须有一台自有医药品冷藏车,才能够通过GSP(药品经营质量管理规范)的认证。另外一种则是受政府监管的第三方物流公司集中采购。

(专业冷藏车。为了保证疫苗的稳定性和抗原性,疫苗全程都需要在8℃以下条件储存)
这个时候,各个城市相关部门对于疫苗的存储运输、供应管理的差距就体现出来了。
在国内各城市中,这方面做得不错的当属上海:
(2016年山东非法经营疫苗案波及全国24个省市,但涉案疫苗却未能流入上海市)
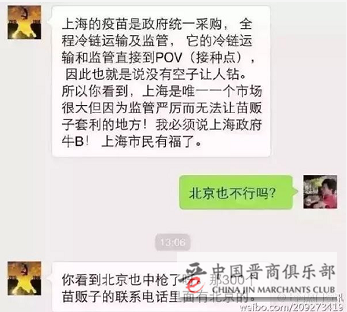
上海疫苗实行的是全面由政府进行统一调配(可能有人会说,这样会不会涉及垄断)。我想说的是,涉及到某些高危行业,就必须实行严格监控,这是底线问题。
马克思就曾说过:“资本如果有百分之五十的利润,它就会铤而走险,如果有百分之百的利润,它就敢践踏人间一切法律,如果有百分之三百的利润,它就敢犯下任何罪行。”人心为谋利可以不择手段,所以如果把疫苗“下放”,很有可能是要出大问题的。
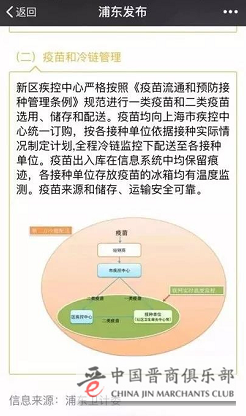
所以,在笔者看来,上海对二类疫苗的管理模式,不失为全国其他城市学习的一个标杆。
在这方面,决策部门需要做的,或许就是消除大众的误解罢了,比如建立公共资源交易平台,让疫苗的采购、交易、管理等信息更公开透明。
03
疫苗的监管问题,是重中之中。
但同样的,还有个问题也显得刻不容缓,那就是疫苗的供需问题。而且这个问题,相比起监管似乎还有些“硬伤”。
怎么说呢?
本质上还是因为厂家“绑架”了市场。就跟前阵子在网络上闹的沸沸扬扬的“滴滴事件”一样,下架滴滴的业务是一件极其容易的事情,但等到真下架后,也会产生一些不必要的麻烦,比如打车更麻烦了。
疫苗的事,也是一样,主流的生产厂家就那么几家,而各厂家的生产能力,在短期内是难有显著提升的。所以,要想在短期内弥补市场缺口还真不是件容易的事情。
可能有人会说,既然国产疫苗供应不足,那直接打进口疫苗不就行了么?还真没那么简单。
中国作为全球最大的人用疫苗市场,不知道有多少外资疫苗企业对中国市场“虎视眈眈”。然而,这些企业想要进入中国市场,并非易事。
中国拥有据说是“全世界最严格”的疫苗监督体系,对进口疫苗的审批则更是把关严密。根据中国现行的《药品注册管理办法》,进口疫苗被批准国内上市之前,必须开展临床试验,除了临床试验外,还要经过1至5年不等的评审时间,才能颁发《进口药品注册证》。
这些审批流程的时间成本巨大,而且中国对进口疫苗的评审标准,也是十分严格:
以宫颈癌疫苗为例。它于2006年在美国上市,此后迅速在全球100多个国家和地区(包括香港、澳门和台湾)被批准使用,然而,大陆地区却拖了整整十年,才同意让宫颈癌疫苗入华。再后来,中国才加速了宫颈癌疫苗4价和9价的引进。
所以,面对疫苗紧缺的问题,似乎还真没有太多办法,作为大众,一方面只能期待国产制药企业能加大研发、扩大生产能力(政府可以给一些优质企业进行财务补贴)。另一方面,如果一定要接种疫苗,估计就只能寻找合理替代方案了,比如接种含相应成分的其他疫苗。
总得来说,中国在医药领域的发展与创新仍然任重而道远。对于中国医药的未来,我们拭目以待。






















































